Il existe diverses méthodes : les plus courantes sont les multi-injections d’insuline par voie sous-cutanée ou la pompe externe à infusion sous-cutanée d’insuline.
D’autres sont plus rares et concernent encore le domaine de la recherche : pompe à insuline implantable ou pancrés artificiel, greffe d’ilôts de langerhans ou de pancréas.  les multi-injections d’insuline les multi-injections d’insuline
Le traitement intensif par multi-injections est représenté par 3 ou 4 injections d’insuline par jour avec des mélanges d’insuline rapide, semi-lente et/ou lente.
Les schémas sont divers :
- Ils peuvent être composés de trois injections d’insuline rapide (actrapid® ou d'ultra rapide avant les repas et d’une injection d’une injection d’insuline semi-lente (insulatard NPH®) au coucher.
- On peut aussi proposer (le plus souvent désormais) une injection d’un mélange d’analogue rapide associée à une insuline semi-lente le matin à jeun, de l’injection d’une analogue rapide à midi et enfin de l’injection du même mélange analogue rapide-semi-lente avant le repas du soir.
- Le schéma peut aussi associer l’injection d’analogues rapide aux trois repas et l’injection d’une insuline retard (ou analogue retard) au coucher le plus souvent.  la pompe à insuline externe ou pompe à infusion sous-cutanée d’insuline la pompe à insuline externe ou pompe à infusion sous-cutanée d’insuline
Ce concept est né à la fin des années 1970. Il avait été matérialisé quelques années plus tôt par l’utilisation en milieu hospitalier de pousse-seringues perfusant de façon continue de l’insuline par voie veineuse. Le choix de la voie sous-cutanée pour la perfusion ambulatoire était légitimé par une plus grande commodité. La mise au point de système perfuseurs miniaturisés, programmables et dotés de systèmes d’alarmes d’arrêt de perfusion, l’élaboration de cathéters compatibles avec la solution d’insuline ( prévention de la précipitation dans la tubulure), mieux tolérés au site de perfusion que les aiguilles métalliques "épi-craniennes" et l’élaboration de solutions d’insuline concentrées à 100 UI/ml, stables au niveau physico-chimique à température ambiante et à l’agitation, ont établi les conditions matérielles d’une perfusion continue sous-cutanée, ambulatoire, sûre, fiable et acceptable de façon prolongée.
La pompe à insuline est composée d’un réservoir rempli d’insuline (rapide) et d’un microprocesseurs fonctionnant avec des piles, ce qui permet au patient de programmer des doses d’insuline à injecter.
Le boîtier est relié au patient par une aiguille ou une canule souple qui est insérée dans le tissu sous-cutané, souvent au niveau de l’abdomen.
Certains cathéters sont déconnectables, mais cette possibilité ne doit pas être utilisée plus d’une heure ou deux. Le cathéter doit être changé tous les 2 ou 3 jours.
L’insuline est délivrée en continu 24 heures sur 24 à petites doses, c’est le débit de base, auquel s’ajoute un bolus d’insuline avant chaque repas.
Les valeurs du débit de base ou des bolus sont toutes décidées et programmées par le médecin à l'initiation du traitement puis adapter par le patient dès le retour au domicile.
La pompe est placée dans son étui et peut-être portée à la taille, dans une poche…  | | Minimed implantable 2007 |
 la pompe à insuline implantable la pompe à insuline implantable
 |
Il s’agit d’un système qui permet l’administration sous-cutanée d’insuline par voie intrapéritonéale. Cette technique est née après la réalisation de travaux expérimentaux chez l’animal et chez l’homme qui ont montré l’efficacité métabolique de la voie intrapéritonéale avec une pharmacocinétique plus proche de la physiologie par rapport à la voie sous-cutanée :
résorption plus rapide et retour plus rapide à l’état basal après un bolus intrapéritonéal d’insuline, reproduction d’un gradient porto-systémique grâce à un premier passage hépatique de l’insuline résorbée.[9,10].
La faisabilité et l’efficacité métabolique des pompes implantables ont été évaluées au début des années 1990 [11] en particulier par les centres français du groupe EVADIAC ( Evaluation dans le Diabète du Traitement par Implants Actifs ) [12,13].
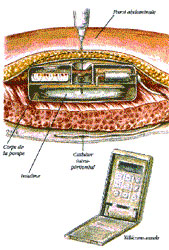
Il existe un seul modèle de pompe implantable : Minimed modèle 2007. C’est un boîtier discoïde de 8 cm de diamètre sur 2 cm d’épaisseur, d’un poids de 150 g environ, accessible pour son remplissage par piqûre transcutanée grâce à une filière repérable au palper.
Le système est implanté dans une fosse iliaque sous anesthésie générale. Le système de perfusion est une micro-pompe pulsatile asservie électroniquement, dont le débit est réglé par télécommande externe transmettant des ondes radio à l’antenne de la pompe à travers la peau.
L’alimentation en énergie est assurée par une pile au lithium dont la longévité a été portée à 8-10 ans. L’insuline est perfusée par un cathéter fixé à la sortie de pompe dont l’extrêmité distale flotte librement dans la cavité péritonéale.
La solution d’insuline doit être stable de façon prolongée à température corporelle, à l’agitation et au contact des matériaux et des systèmes de perfusion. Il s’agit d’une insuline de pH neutre, tamponnée, concentrée à 400 UI/ ml, stabilisée avec un agent tensio-actif, le génapol : l’insuline 21 PH du laboratoire Hoechst.
Les premières expériences cliniques de perfusion intrapéritonéale ont confirmé l’obtention d’un contrôle glycémique proche de la normale avec des écarts hyper- et hypoglycémiques moindres par rapport à la perfusion sous-cutanée d’insuline [14].
Les indications de ce traitement sont réduites et demeurent même confidentielles : dans tous les cas, il s’agit de patients bien impliqués dans un traitement intensif dont le contrôle est insuffisant par les multi-injections ou la pompe externe, avec une HbA1c supérieure à 8% ou des hypoglycémies sévères répétées. |
  la greffe de pancréas la greffe de pancréas
Les inconvénients d’un tel traitement sont la nécessité de poursuivre un traitement immunosuppresseur au long cours après la réalisation d’une intervention chirurgicale qui doit associer le plus souvent, à la greffe pancréatique, une greffe rénale.
Ce traitement biologique du diabète ne peut donc concerner que les patients atteints de DT1 ayant une insuffisance rénale terminale.
Les études, en particulier Italiennes [15], ont montré en plus d’une survie intéressante, la restauration de la sécrétion d’insuline, d’un équilibre glycémique normal ainsi que de l’hémoglobine glyquée.  la greffe d’îlots de langerhans la greffe d’îlots de langerhans
Il s’agit d’un autre type de traitement biologique par allotransplantation d’îlots de cellules β de langerhans et qui se présente comme une alternative à la transplantation de pancréas.
Le geste opératoire est plus simple avec abord percutané de la veine porte, suivi d’une injection intrahépatique d’îlots purifiés par digestion enzymatique de la glande.
Récemment, en 2000, l’équipe d’Edmonton au Canada [16] a publié une série de 7 cas avec obtention d’une insulino-indépendance après une greffe d’îlots de langerhans. Les patients inclus présentaient tous un diabète instable avec de nombreuses hypoglycémies non ou mal ressenties et l’absence de complications microvasculaires.
La particularité du traitement immunosuppresseur appliqué a été de ne pas utiliser de glucocorticoïdes et d’utiliser des molécules immunosuppressives moins toxiques pour les cellules β.
Les résultats obtenus ont été la réduction des accidents hypoglycémiques, la normalisation glycémique avec réduction de l’hémoglobine glyquée A1c et l’augmentation durable du peptide C.
Le devenir des patients à long terme n’est pas encore connu, de même que les éventuelles complications liées à l’immunosuppression. Si les résultats de cette technique se confirment, l’indication de greffe d’îlots sera de toute façon confrontée à la pénurie d’organes. |